552292
Cardisure Flavoured Vet. 1,25 mg
100 stk. (blister)
tabletter
Receptpligtig medicin
Indikationer
Til behandling af kongestiv hjerteinsufficiens hos hunde hidrørende fra valvulær insufficiens
(mitral og/eller tricuspidal tilbagestrømning) eller dilateret kardiomyopati.
Dosering
Oral anvendelse:
Den anbefalede dosis bør ikke overskrides.
For at sikre korrekt dosering bør legemsvægten bestemmes så nøjagtigt som muligt.
Tabletterne indgives oralt med en dosis på mellem 0,2 og 0,6 mg/kg kropsvægt dagligt. Den
anbefalede, daglige dosis er 0,5 mg pimobendan/kg kropsvægt.
Indgivelsen fordeles på to daglige doseringer hver på 0,25 mg/kg kropsvægt – fordelt med en
dosering om morgenen og den anden cirka 12 timer senere. Vedligeholdelsesdoseringen
fastlægges individuelt af den ansvarlige dyrlæge, afhængig af lidelsens sværhedsgrad.
Veterinærlægemidlet kan eventuelt kombineres med en vanddrivende behandling med f.eks.
furosemid.
1,25 mg tabletter:
Tabletten deles ved at placere denne på en jævn overflade med delekærven opad. Hold på den
ene halvdel og tryk den anden nedad.
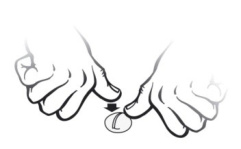
Veterinærlægemidlet skal indgives cirka en time før fodring.
mg, 52,5 mg, 10 mg tabletter:
En tablet med krydset, dobbelt delekærv deles i kvarte ved at lægge denne på en jævn
overflade med delkærvssiden opad. Tryk på tablettens midte med tommelfingeren.
Veterinærlægemidlet skal indgives cirka en time før fodring.

Tilbageholdelsestid
Bivirkinger
Hunde:
| Sjælden (1 til 10 dyr ud af 10.000 behandlede dyr): |
Øget hjertefrekvensa,b, Øget mitral tilbagestrømningc Opkastningb, Diarréd Anorexid, Letargid |
| Meget sjælden (< 1 dyr ud af 10.000 behandlede dyr, herunder enkeltstående indberetninger): |
Petechiae på mucosae, Subkutan blødninge |
a Moderat positiv kronotrop effekt.
b Disse bivirkninger er dosisafhængige og kan undgås ved dosisreduktion.
c Er blevet observeret i forbindelse med kronisk pimobendanbehandling hos hunde med
mitralklapsygdom.
d Forbigående.
e Der kan observeres tegn på primær hæmostase under behandlingen, skønt der ikke kunne
fastslås en direkte sammenhæng med pimobendan. Symptomerne forsvinder ved ophør af
behandlingen.
Indberetning af bivirkninger er vigtigt, da det muliggør løbende sikkerhedsovervågning af et
veterinærlægemiddel. Indberetningerne sendes, helst via en dyrlæge, til enten indehaveren af
markedsføringstilladelsen eller dennes lokale repræsentant eller til den nationale kompetente
myndighed via det nationale indberetningssystem. Se indlægssedlen for de relevante
kontaktoplysninger.
Drægtighed, diegivning og laktation
Laboratorieundersøgelser af rotte og kanin har ikke afsløret teratogene virkninger eller
føtal toksicitet. Samme studier har dog vist maternel toksicitet og embryonal toksicitet ved
høje doser, ligesom de påviste at pimobendan udskilles i modermælk. Præparatets
sikkerhed er ikke undersøgt hos drægtige eller diegivende tæver. Må kun anvendes i
overensstemmelse med den ansvarlige dyrlæges vurdering af risk-benefit-forholdet.
Opbevaring
Må ikke opbevares over 30°C.
Delte tabletter opbevares i den åbnede blisterpakning og skal anvendes inden 3 dage.
Holdbarhed
I salgspakning: 30 måneder.
Opbevaringstid af halverede tabletter efter første åbning af blisterpakningen: 3 dage.






